BIENVENIDOS A MI BLOG DEL ENLACE QUÍMICO.
DANIELA FERNANDA CLAVIJO FORERO 10-1
EL ENLACE QUÍMICO.
PARA SABER MAS!!
Los elementos químicos se combinan de diferentes maneras para formar toda una variedad de compuestos inorgánicos y orgánicos. Hay compuestos gaseosos, líquidos y sólidos, los hay tóxicos e inocuos, mientras que otros son altamente benéficos para la salud. Las propiedades de cada compuesto dependen del tipo de elemento químico que lo forman, el modo cómo se enlazan (tipo de enlace químico), la forma y geometría de los agregados atómicos (moléculas) y de como estos interactúan entre si.
En 1916, el químico alemán Walther Kossel expuso que en las reacciones químicas ocurren perdida y ganancia de electrones por parte de los átomos, y por ello estos adquieren la configuración electrónica de un gas noble. Sin duda Kossel se refería al enlace iónico, y por lo tanto a los compuestos iónicos.
Posteriormente los químicos norteamericanos Gilbert Newton Lewis e Irving Langmuir, cada uno en forma independiente estudiaron los compuestos iónicos y no iónicos (covalentes), comprobando que los átomos al formar enlace químico adquieren en su mayoría la estructura atómica de un gas noble (8 electrones en el nivel externo), lo que hoy se llama Regla del Octeto.
En 1923, G.N.Lewis plantea su teoría de enlace por pares de electrones y anuncia que el octeto se logra por medio de compartición de electrones. Entonces a Kossel lo podemos considerar como el padre del enlace iónico, y a Lewis el padre del enlace covalente.
En 1926, Walter Heitler y Fritz London demostraron que el enlace covalente en la molécula de H2 se podría explicar mediante la mecánica cuántica.
La mecánica cuántica describe muy bien a los átomos y estructura electrónica de los mismos; pero la situación en la molécula es muy diferente debido a la mayor complejidad de esta, el aparato matemático es mucho mas difícil de formular y los resultados menos fáciles de obtener e interpretar.
Hoy en día, los químicos disponen de métodos de calculo y de técnicas experimentales muy sofisticadas que permiten conocer con exactitud la forma, geometría y dimensiones de las moléculas.
¿Como se forman los compuestos químicos existentes en la naturaleza?
R// Los compuestos químicos se forman de la siguiente manera:
Tipo de compuesto
|
Fórmula
|
Nombre
|
Estado físico a temperatura ambiente
|
Características
|
Hidruros
|
H2O
|
Agua
|
Líquido
|
Es el disolvente universal y el líquido más importante de los seres vivos
|
NH3
|
Gas
|
Olor característico. Forma parte de muchos productos de limpieza y también se utiliza para fabricar abonos.
| ||
Óxidos no metálicos
|
CO2
|
Dióxido de carbono
|
Gas
|
Se produce en la respiración y en las combustiones. Es contaminante pero no tóxico. Responsable del efecto invernadero
|
CO
|
Monóxido de carbono
|
Gas
|
Es tóxico: puede producir la muerte pos asfixia. Se produce en las combustiones cuando hay poco oxígeno
| |
SO2
|
Dióxido de azufre
|
Gas
|
Se producen en la combustión de los compuestos de azufre (carbón, derivados del petróleo). Son contaminantes
| |
SO3
|
Trióxido de azufre
|
Gas
| ||
NO2
|
Dióxido de nitrógeno
|
Gas
|
Es venenoso. Se produce en la combustión de compuestos que contienen nitrógeno (derivados del petróleo). Es contaminante.
| |
Óxidos metálicos
|
FeO
|
Óxido de hierro (II)
|
Sólido
|
Se forman cuando se oxida el metal hierro. Producen la herrumbre
|
Fe2O3
|
Óxido de hierro (III)
|
Sólido
| ||
HCl
|
Ácido colrhídrico
|
Gas
|
Lo segregamos en el estómago para hacer la digestión. Cuando se produce en exceso sentimos Aacidez de estómago@
Disoluciones diluidas de éste ácido se venden como agua fuerte, un producto para limpiar metales
| |
HNO3
|
Ácido nítrico
|
Líquido
|
Se utiliza para fabricar abonos, explosivos, etc
Responsable de la lluvia ácida
| |
H2SO4
|
Ácido sulfúrico
|
Líquido denso
|
Gran importancia como producto industrial.
Principal responsable de la lluvia ácida
| |
Hidróxidos
|
NaOH
|
Hidróxido de sodio
|
Sólido
|
Sólidos conocidos también como sosa y potasa. Forman parte de muchos productos de limpieza como la lejía
La sosa se usa en la fabricación del jabón
|
KOH
|
Hidróxido de potasio
|
Sólido
| ||
Al(OH)3
|
Hidróxido de aluminio
|
Sólido
|
Sólido que se utiliza para fabricar antiácidos, sustancias que se forman cuando se sufre ardor de estómago
| |
Sales
|
NaCl
|
Cloruro de sodio
|
Sólido
|
Es el compuesto conocido como sal común. Es el condimento más empleado al cocinar
|
CaCl2
|
Cloruro de calcio
|
Sólido
|
Absorbe la humedad. Se utiliza como desecante en embalajes
| |
CaCO3
|
Carbonato de calcio
|
Sólido
|
Es el compuesto que forma el mármol. Es insoluble en agua, pero lo atacan los ácidos
| |
NaHCO3
|
Sólido
|
Se utiliza para combatir la acidez de estómago y también como levadura en panadería
| ||
CuSO4
|
Sulfato de cobre (II)
|
Sólido
|
Se usa como producto fitosanitario; se rocían las vides con una disolución de sulfato de cobre para protegerlas del mildiu, un hongo que las ataca
| |
KNO3
|
Nitrato de potasio
|
Sólido
|
Se emplea como abono
|
El átomo de carbono forma la mayor parte de los compuestos presentes en los seres vivos y por este motivo a los compuestos de carbono se les llama orgánicos.Al resto de compuestos se les llama inorgánicos porque se encuentran fundamentalmente en el mundo inanimado
- Para saber mas....
A) Entiendo por enlace químico Enlace significa unión, un enlace químico es la unión de dos o más átomos con un solo fin, alcanzar la estabilidad, tratar de parecerse al gas noble más cercano. Para la mayoría de los elementos se trata de completar ocho electrones en su último nivel.Las fuerzas atractivas que mantienen juntos los elementos que conforman un compuesto, se explican por la interacción de los electrones que ocupan los orbitales más exteriores de ellos (electrones de valencia).
Cuando dos átomos se acercan se ejercen varias fuerzas entre ellos. Algunas de estas fuerzas tratan de mantenerlos unidos, otras tienden a separarlos.
En la mayoría de los átomos, con excepción de los gases nobles (muy estables, con su última capa o nivel de energía completo con sus ocho electrones), las fuerzas atractivas son superiores a las repulsivas y los átomos se acercan formando un enlace.
Así, podemos considerar al enlace químico como la fuerza que mantiene unidos a dos o más átomos dentro de una molécula.
Todos los enlaces químicos resultan de la atracción simultánea de uno o más electrones por más de un núcleo.
B)Propiedades para la formación de enlaces:
- Energía de ionización:El potencial de ionización es la energía que hay que suministrar a un átomo neutro, gaseoso y en estado fundamental, para arrancarle el electrón más débil retenido.Podemos expresarlo así:Átomo neutro gaseoso + Energía -----> Ion positivo gaseoso + e -Siendo esta energía la correspondiente a la primera ionización. El segundo potencial de ionización representa la energía precisa para sustraer el segundo electrón; este segundo potencial de ionización es siempre mayor que el primero, pues el volumen de un ion positivo es menor que el del átomo y la fuerza electrostática es mayor en el ion positivo que en el átomo, ya que se conserva la misma carga nuclear.
.
- Afinidad electrónica:La afinidad electrónica de un elemento (AE), puede definirse como:La cantidad de energía que se absorbe cuando se añade un electrón a un átomo gaseoso aislado para formar un ión de carga 1-La convención es asignar un valor positivo cuando se absorbe energía y un valor negativo cuando se libera y caso todos los elementos no tienen afinidad por un electrón adicional, por tanto, su afinidad electrónica es igual a cero. La afinidad electrónica de los elementos He y Cloro puede representarse como:
He(g) + e- x He- (g) AE = 0 kj/molCl(g) + e- → Cl- (g) + 349 kj AE = -349 kj/mol
La primera ecuación nos dice que el Helio no admitirá un electrón. La segunda ecuación nos dice que cuando una mol de átomo de cloro gaseoso gana un electrón para formar iones cloruro gaseoso, se libera (exotérmico) 349 kj de energía.La afinidad electrónica comprende la adición de un electrón a un átomo gaseoso neutro. Así como el proceso por el cual un átomo neutro X gana un electrón.X(g) + e- →X-(g) (AE)no es el inverso del proceso de ionizaciónX+(g) + e- →X(g) ( inverso de EI1)El primer proceso comienza con un átomo neutro en tanto que el segundo comienza con un ión positivo; por tanto, los valores de EI1 y de la AE no son simplemente iguales pero de signo contrario. En la figura 6.3 vemos que, al recorrer un periódo de la tabla periódica la afinidad electrónica se vuelve, en general,más negativa de izquierda a derecha ( excluyendo a los gases nobles), lo cual significa que casi todos los elementos representativos de los grupos 1A a 7ª muestran gran atracción por un electrón extra de izquierda a derecha. La afinidad electrónica más negativa corresponde a los átomos de los halógenos, cuya configuración electrónica más externa es ns2np5, los cuales forman aniones estables con configuración de gas noble, ns2np6 al ganar un electrón.Los elementos con afinidad electrónica muy negativa gana electrones con facilidad formando iones negativos (aniones).La afinidad electrónica es un término preciso y cuantitativo como la energía de ionización, pero es difícil medirla.
- Electronegatividad
a electronegatividad y viceversa.
- Valencia
La valencia, es el número de electrones que tiene un elemento en su último nivel de energía, son los que pone en juego durante una reacción química o para establecer un enlace con otro elemento. Hay elementos con más de una valencia, por ello se reemplaza a este concepto con el de números de oxidación que a fin de cuentas representa lo mismo. Existen distintas clases de valencia. La valencia positiva máxima es el dígito positivo que refleja la más alta
capacidad de un átomo para combinarse y que es igual para el grupo al que corresponda en la
tabla periódica de los elementos. La valencia negativa, en cambio, es el dígito negativo
que muestra las posibilidades del átomo para ser combinado con otro que se presente con una
valencia positiva.
- Numero de oxidación.
Se denomina numero de oxidación ala carga que se le asigna a un átomo cuando los electrones de enlace se distribuyen según ciertas reglas un tanto arbitrarias.
Reglas:
Los electrones compartidos por átomos de idéntica electronegatividad se distribuyen en forma equitativa entre ellos.
Los electrones compartidos por átomos de diferente electronegatividad se le asignan al mas electronegativo.
Luego de esta distribución se compara el numeró de electrones con que ha quedado cada átomo con el numero que posee el átomo neutro, y ese es el numero de oxidación. Este se escribe en general, en la parte superior del símbolo atómico y lleva el signo escrito .
3)La diferencia que hay entre valencia y numero de oxidación es que la valencia es el numero de electrones que hay en el ultimo nivel de energía y son los que sirven para coger un enlace con otro en cambio numero de oxidación se comparten átomos de idéntica electronegatividad y se distribuyen equitativamente es decir de igual numero en cada equipo y otra diferencia es que los átomos compartido de diferente electronegatividad se le asignan al mas electronegativo.
4)Diferentes tipos de enlaces químicos:
Definición:
Como dije anteriormente es el proceso responsable de las interacciones atractivas entre átomos, moléculas e iones, que tiene una estabilidad en los compuestos químicos diatómicos y poliatómicos.
Ejemplos:
ENLACE IONICO: consiste en la atracción electrostática entre átomos con cargas eléctricas de signo contrario. Este tipo de enlace se establece entre átomos de elementos poco electronegativos con los de elementos muy electronegativos. Es necesario que uno de los elementos pueda ganar electrones y el otro perderlo, y como se ha dicho anteriormente este tipo de enlace se suele producir entre un no metal (electronegativo) y un metal (electropositivo).Un ejemplo de sustancia con enlace iónico es el cloruro sódico.En su formación tiene lugar la transferencia de un electrón del átomo de sodio al átomo de cloro. Las configuraciones electrónicas de estos elementos después del proceso de ionización son muy importantes, ya que lo dos han conseguido la configuración externa correspondiente a los gases nobles, ganando los átomos en estabilidad. Se produce una transferencia electrónica, cuyo déficit se cubre sobradamente con la energía que se libera al agruparse los iones formados en una red cristalina que, en el caso del cloruro sódico, es una red cúbica en la que en los vértices del paralelepípedo fundamental alternan iones Cl- y Na+. De esta forma cada ion Cl- queda rodeado de seis iones Na+ y recíprocamente. Se llama índice de coordinación al número de iones de signo contrario que rodean a uno determinado en una red cristalina. En el caso del NaCl, el índice de coordinación es 6 para ambos
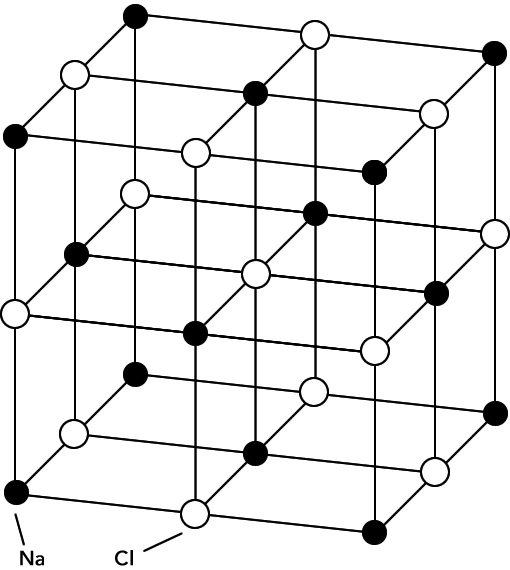
Los compuestos iónicos estado sólido forman estructuras reticulares cristalinas. Los dos factores principales que determinan la forma de la red cristalina son las cargas relativas de los iones y sus tamaños relativos. Existen algunas estructuras que son adoptadas por varios compuestos, por ejemplo, la estructura cristalina del cloruro de sodio también es adoptada por muchos haluros alcalinos y óxidos binarios, tales como MgO.

ENLACE COVALENTE: Lewis expuso la teoría de que todos los elementos tienen tendencia a conseguir configuración electrónica de gas noble (8 electrones en la última capa). Elementos situados a la derecha de la tabla periódica ( no metales ) consiguen dicha configuración por captura de electrones; elementos situados a la izquierda y en el centro de la tabla ( metales ), la consiguen por pérdida de electrones. De esta forma la combinación de un metal con un no metal se hace por enlace iónico; pero la combinación de no metales entre sí no puede tener lugar mediante este proceso de transferencia de electrones; por lo que Lewis supuso que debían compartirlos.
Es posible también la formación de enlaces múltiples, o sea, la compartición de más de un par de electrones por una pareja de átomos. En otros casos, el par compartido es aportado por sólo uno de los átomos, formándose entonces un enlace que se llama coordinado o dativo. Se han encontrado compuestos covalentes en donde no se cumple la regla. Por ejemplo, en BCl3, el átomo de boro tiene seis electrones en la última capa, y en SF6, el átomo de azufre consigue hasta doce electrones. Esto hace que actualmente se piense que lo característico del enlace covalente es la formación de pares electrónicos compartidos, independientemente de su número.
PARA SABER MAS...
Propiedades de los compuestos iónicos
Las sustancias iónicas están constituidas por iones ordenados en el retículo cristalino; las fuerzas que mantienen esta ordenación son fuerzas de Coulomb, muy intensas. Esto hace que las sustancias iónicas sean sólidos cristalinos con puntos de fusión elevados. En efecto, para fundir un cristal iónico hay que deshacer la red cristalina, separar los iones. El aporte de energía necesario para la fusión, en forma de energía térmica, ha de igualar al de energía reticular, que es la energía desprendida en la formación de un mol de compuesto iónico sólido a partir de los correspondientes iones en estado gaseoso. Esto hace que haya una relación entre energía reticular y punto de fusión, siendo éste tanto más elevado cuanto mayor es el valor de aquella.
PARA SABER MAS...
Fuerzas intermoleculares.
A diferencia que sucede con los compuestos iónicos, en las sustancias covalentes existen moléculas individualizadas. Entre estas moléculas se dan fuerzas de cohesión o de Van der Waals, que debido a su debilidad, no pueden considerarse ya como fuerzas de enlace. Hay varios tipos de interacciones: Fuerzas de orientación (aparecen entre moléculas con momento dipolar diferente), fuerzas de inducción (ion o dipolo permanente producen en una molécula no polar una separación de cargas por el fenómeno de inducción electrostática) y fuerzas de dispersión (aparecen en tres moléculas no polares).
Enlace metálico.
Los elementos metálicos sin combinar forman redes cristalinas con elevado índice de coordinación. Hay tres tipos de red cristalina metálica: cúbica centrada en las caras, con coordinación doce; cúbica centrada en el cuerpo, con coordinación ocho, y hexagonal compacta, con coordinación doce. Sin embargo, el número de electrones de valencia de cualquier átomo metálico es pequeño, en todo caso inferior al número de átomos que rodean a un dado, por lo cual no es posible suponer el establecimiento de tantos enlaces covalentes.En el enlace metálico, los átomos se transforman en iones y electrones, en lugar de pasar a un átomo adyacente, se desplazan alrededor de muchos átomos. Intuitivamente, la red cristalina metálica puede considerarse formada por una serie de átomos alrededor de los cuales los electrones sueltos forman una nube que mantiene unido al conjunto.
UN DATO CURIOSO:
POLARIDAD DE LOS ENLACES
En el caso de moléculas heteronucleares, uno de los átomos tendrá mayor electronegatividad que el otro y, en consecuencia, atraerá mas fuertemente hacia sí al par electrónico compartido. El resultado es un desplazamiento de la carga negativa hacia el átomo más electronegativo, quedando entonces el otro con un ligero exceso de carga positiva. Por ejemplo, en la molécula de HCl la mayor electronegatividad del cloro hace que sobre éste aparezca una fracción de carga negativa, mientras que sobre el hidrógeno aparece una positiva de igual valor absoluto. Resulta así una molécula polar, con un enlace intermedio entre el covalente y el iónico.
ACTIVIDAD:
WEBGRAFIA:
- Http://www.profesorenlinea.cl/Quimica/Enlace_quimico.html
- http://www.mcgraWhill.es/bcv/tabla_periodica/de fi/de finicion_potencial_energia_ionizacion.html
- http://electronegatividad08.blogspot.com
- http://www.educaquimica.com/index.php?option=com_content&view=article&id=711<emid=439
- http:/www.tectoscientificos.com/quimica/enlaces-quimicos
- http://www.fullquimica.com/2011/04/enlace-quimico.html
.jpg)

.jpg)


.jpg)


No hay comentarios:
Publicar un comentario